#インドアニリン色素形成
Text
世界初のインドアニリン色素形成反応速度論(5)
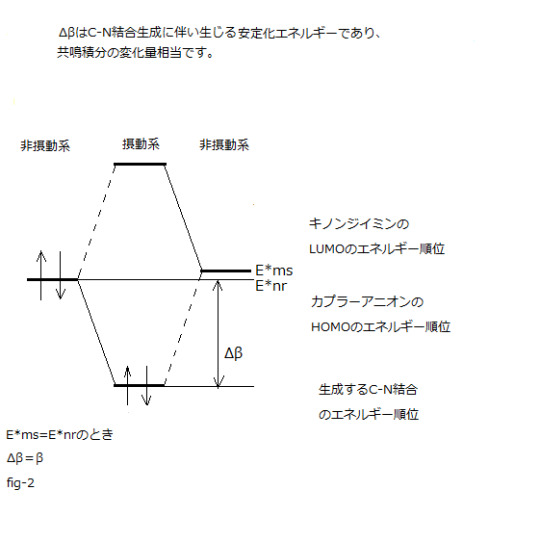
⊿Etotal=-qr・qs / Rrs +2(Cmrr・ Cnss・⊿β)² /(E*nr-E*ms)
(第二項クーロン項) (第三項電子移動相互作用項) (第一項は省略)
E*nr-E*ms= 0 の場合の⊿E
上記の式に換えて ⊿E=2・Cmrr・Cnss・⊿βを用います。
この時に負の値である⊿βの絶対値は最大(⊿β=β)になります。
摂動法について.
摂動法は測定又は計算済みの既知のエネルギー順位に基づいて、
新たに生ずる結合のエネルギー順位の計算を簡略に行う方法です。
具体的には共鳴積分の変化量(⊿β)を知ることであり、
作図 (fig-2)が摂動法の理解を容易にします。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(9)
1H-ピラゾロ[5,1-C] [1,2,4] トリアゾール (以下、ピラゾロトリアゾールと呼ぶ。)。
ピラゾロトリアゾールはカプラーです。
4等量のピラゾロトリアゾールの母核上の置換基の種類によって、
そのカプラーのHOMOのエネルギー順位は適正な範囲内であっても高いもの(H)と低いもの(L)とがあります。
それらのカプラーの活性点の炭素原子にハロゲン原子を導入すると、
そのカプラーの(ネクスト)HOMOのエネルギー順位は低下します。
(ハロゲン原子をカプラー活性点の炭素に導入た場合には、
HOMOのエネルギー順位だけではなくネクストHOMOのエネルギー順位をも考慮する必要があります。)
(H)の場合に(ネクスト)HOMOのエネルギー順位は適正な範囲内であって、ハロゲン化された2等量カプラーは充分なカップリング反応性を示します。
(L)の場合には(ネクスト)HOMOのエネルギー順位は適正な範囲を超えて低下し、ハロゲン化された2等量カプラーは不充分なカップリング反応性を示します。
なお、ピラゾロトリアゾール(H)から生じるシアン色素を、
ピラゾロトリアゾール(L)から生じるシアン色素と比べてみると、
トリアゾール側において短波化して吸収波形のショルダーとなって現れています。
(世界初のインドアニリン色素形成反応速度論(6)参照)
フェノールカプラーと2-カルバモイルナフトールカプラー
従来の4等量フェノールカプラーを(H)とし4等量2-カルバモイルナフトールカプラーを(L)とした場合においても、
同様な現象が起きていました。
(H)も(L)も充分なカップリング反応性を示します。
(H)の活性点をハロゲン化した2等量カプラーは充分なカップリング反応性を示します。
(L)の活性点をハロゲン化した2等量カプラーは不充分なカップリング反応性を示します。
従って、これらの現象はこのブログにおいて述べてきた論理に基づき説明することが出来ます。
アゾメチン色素形成反応
カップリング反応速度における、4等量カプラーと2等量カプラーとの関係及び、
色素形成反応速度における、4等量カプラーと2等量カプラーとの関係並びに、
カップリング反応速度と色素形成反応速度との関係は、
アゾメチン色素形成反応においても、このブログにおいて述べてきた論理に基づき説明することが出来ます。
HOMO : Highest Occupied Molecular Orbital 最高被占軌道
LUMO : Lowest Unoccupied Molecular Orbital 最低空軌道
完
表題のとうりである反応速度論そのものを除き、
本ブログに記載された事実は全て周知または公知の内容です。
参考文献等:更なる詳細については以下の出版物等を参照されたい。
The Theory of the Photographic Process FOURTH EDITION Edited by T.H.James MACMILLAN PUBLISHING CO., INC.
分子軌道法 広田 穣 著 裳華房
フロンティア軌道法入門 I.フレミング 著 福井 謙一 監修 竹内 敬人・友田 修司 訳 講談社サイエンティフィク
演習有機反応 稲本 直樹・秋葉欣哉・岡崎廉治 著 株式会社 南江堂
物理化学 Raymond Chang 著 岩澤 康裕・北川 禎三・濱口 宏夫 訳 東京化学同人
KONICA MINORUTA TECHNOLOGY REPORT VOL2 (2005)
https://research.konicaminolta.com/jp/pdf/technology_report/2005/pdf/treatise_014.pdf
Klopman/ Salem Equation
http://ramsey1.chem.uic.edu/chem533/page5/page10/files/Klopman-Salem%20Equation.pdf
0 notes
Text
世界初のイ���ドアニリン色素形成反応速度論(8)
活性点が置換されている2-カルバモイルナフトール
ⅰ)2-カルバモイルナフトールの活性点の炭素にハロゲン原子を導入すると、
(ネクスト)HOMOのエネルギー順位(E*nr)は下降して適正な範囲以下になってCoupring反応が遅くなってしまいます。
(ハロゲン原子をカプラー活性点の炭素に導入た場合には、
HOMOのエネルギー順位だけではなくネクストHOMOのエネルギー順位をも考慮する必要があります。)
「世界で初めてのインドアニリン色素形成反応速度論(4)」に記載した k'>>k の場合該当して、
インドアニリン色素形成反応速度は遅くなって充分な色素濃度範囲以下となってしまいます。
ⅱ)2-カルバモイルナフトールの活性点に、
酸素原子を介して置換基を導入すると、
HOMOのエネルギー順位(E*nr)は適正な範囲内で上昇します。
Coupring反応性を損なうことはないけれど、
活性点炭素上の分子軌道係数(Cmrr)の減少は避けられないので、
Coupring反応を促進する値にまでには至りません。
それでも魔法の世界は回ります!
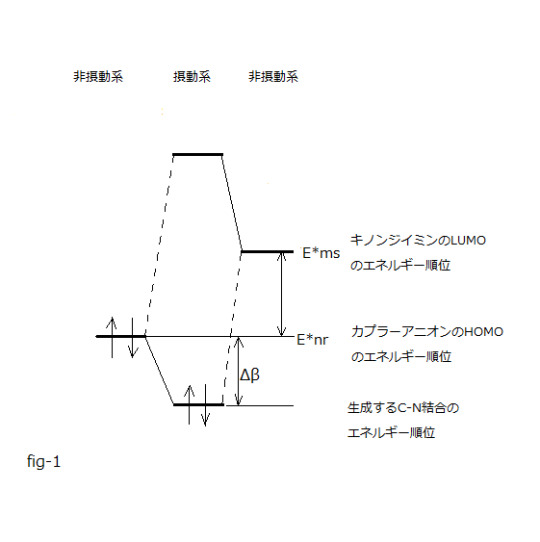
⊿Etotal=-qr・qs / Rrs +2(Cmrr・Cnss・⊿β)² /(E*nr-E*ms)
(第二項クーロン項) (第三項電子移動相互作用項) (第一項は省略)
式中
E*nr はカプラーアニオンHOMOのエネルギー順位、 E*msはキノンジイミンLUMOのエネルギー順位、
Cmrrはカプラー活性点炭素上のHOMOの分子軌道係数、
Cnssはキノンジイミン反応点窒素 上のLUMOの分子軌道係数、
⊿βはC-N結合生成に伴い生ずる安定化エネルギーであり共鳴積分の変化量相当です。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(7)
ナフトール系カプラーとフェノール系カプラー
ナフトール系カプラーとフェノール系カプラーとの
HOMOエネルギ順位について思案してみましょう。
ナフタレンのHOMOのエネルギー順位は、
ベンゼンのそれよりも0.382β程高くなっています。
2-カルバモイルナフトールと2-カルバモイルフェノールとの
HOMOのエネルギー順位にもほぼ同様の関係が生じていると類推さます。
2-カルバモイルナフトールのHOMOのエネルギー順位は、
適正な範囲内にあるのでCoupring反応をして発色します。
しかし、2-カルバモイルフェノールのHOMOのエネルギー順位は、
適正な範囲以下となってCoupring反応をしないので発色しません。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(6)
色素が吸収する光の波長の長波化と短波化
共役二重結合
共役関係にある二重結合の数が増えると、 その化合物のHOMOのエネルギー順位は上昇し、 それに対して、負の相関をしてLUMOのそれは下降します。 その結果、LUMOとHOMOとのエネルギー順位の差(LUMO-HOMO)は小さくなり、 その化合物が吸収する光の波長は長波化します。 その二重結合の数が減ると、 その化合物の吸収する光の波長は短波化します。
電子吸引性基の導入
特定波長の光を吸収する化合物に、 電子吸引性の原子や置換基を導入すると、 吸収する光にの波長は長波化します。 電子吸引性の原子や置換基を導入すると、 その化合物のHOMOのエネルギー順位は下降します。 その時その化合物のLUMOのエネルギー順位は、 その化合物のHOMOのエネルギー順位よりももっと大きな幅を持って下降します。 エネルギー順位の差(LUMO-HOMO)は縮小するので、 吸収する光にの波長は長波化します。
電子供与性基の導入
電子供与性の置換基をその化合物に導入すると、 吸収する光の波長は短波化します。 その化合物のHOMOのエネルギー順位は上昇します。 その時その化合物のLUMOのエネルギー順位は、 その化合物のHOMOのエネルギー順位よりももっと大きな幅を持って上昇します。 エネルギー順位の差(LUMO-HOMO)は拡大するので、 吸収する光の波長は短波化します。
この様に置換基を導入するとエネルギー順位の変動は、 LUMOのほうがHOMOよりも同じ向きに大きくなっています。 その化合物に電子供与性の基を導入することにより、吸収する光の波長は短波化し、 電子吸引性の基を導入することにより、吸収する光の波長は長波化することになります。
参考までに
クーロン積分値(α₁、α₂)、共鳴積分値(β)及び重なり積分値(S=0.25~0.30)と ーー(HOMO、LUMO) との関係は次式によって表されます。
HOMO=(α₁+β)/(1+S) LUMO=(α₂-β)/(1-S) これらの式から直感的にLUMOの変化はHOMOの変化よりも大きいことが分かるでしょう。 それで充分です。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(4)
homoとlumoとの電子移動相互作用の絶対値 | ⊿Etotal | は反応速度とは直接関連するものではありませんが、
当該関連性を類推できる場合があります。既述のhomo とlumoとのCoupling反応はその類推できる場合です。
そういう訳で、電子移動相互作用の絶対値 | ⊿Etotal | が減少することによって、活性化エネルギー(E₀)は大きくなり、
Coupling反応速度常数が減少してCoupling反応速度が遅くなります。
魔法の反応が実現する場合
上記2等量カプラーのCoupling反応の反応速度定数が、
4等量カプラーの場合に比べて小さくても、
当該Coupling反応のLUMO (N,N-ジアルキルキノンジイミン) が稀薄な状態という一定の事情の下で、
2等量カプラーからのインドアニリン色素形成速度は速くなる場合があります。
a)活性点置換型2-カルバモイルナフトールの場合:
Coupling反応速度常数=k ( k<k ')
色素形成速度
= d[Dye(a)]/dt = k[c][q]
=k([c。]-[Dye(a)])([q。]-[Dye(a)])
b)2-カルバモイルナフトールの場合:
Coupling反応速度常数=k' ( k'>k )
色素形成速度
= d[Dye(b)]/dt = k'[c][q]²
=k'([c。]-[Dye(b)])([q。]-2[Dye(b)])²
魔法を回す特殊な事情
当該Coupling反応のLUMO (N,N-ジアルキルキノンジイミン) が稀薄な状態という一定の事情とは、上記の式中 1 > [q] > [q]² の関係が成立していることを意味します。
斯かる状態で反応させることによって、2等量カプラーが有用であることを見出すことができるという一定の事情です。
式中、
1 > [q] > [q]² であり,
1 > ([q。]-[Dye(a)]) > ([q。]-2[Dye(b)])² であるから、
k < k'であっても色素形成速度は d[Dye(a) ]/dt > d[Dye(b) ]/dt となり得ます。
魔法の反応が実現しない場合
k '>> k の場合には、色素形成速度が
d[Dye(a) ]/dt > d[Dye(b) ]/dt とならないこともあります。
⊿Etotal=-qr・qs /Rrs + 2(Cmrr・ Cnss・⊿β)² /(E*nr-E*ms)
(第二項クーロン項) (第三項電子移動相互作用項) (第一項は省略)
k '>>k の場合、
d[Dye(a) ]/dt > d[Dye(b) ]/dtの関係は実現しません。
活性点に置換基を導入すると活性点上の原子の分子軌道係数(Cmrr)は小さくなり、
式⊿Etotal中の分子は小さくなります。
さらに、カプラーアニオンHOMOのエネルギー順位(E*nr)が下がると、 キノンジイミンLUMOとそのHOMOとのエネルギー順位の差(E*nr-E*ms)は大きくなり、
式⊿Etotal中の分母の絶対値は大きくなります。
同時に、⊿Etotaの式の分子である負の⊿βの絶対値が減少することにより、⊿Etotaの絶対値が減少します。
活性化エネルギーE₀の増加によるCoupling反応速度常数 kの減少により、k'>>k の関係が生じます。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(3)
活性点未置換型フェノール系又はナフトール系カプラーからのインドアニリン色素形成反応
活性点未置換型フェノール系又はナフトール系カプラー(以下、4等量カプラーと呼ぶ。)
4等量カプラーの弱塩基アニオンがHOMOになり、
N,N-ジアルキルパラフェニレンジアミンの二電子酸化体である弱酸N,N-ジアルキルキノンジイミンがLUMOになります。
4等量カプラーのアニオン(HOMO)と
N,N-ジアルキルキノンジイミン(LUMO)とのCoupling反応により
C-N 一重結合が形成され、
C-N結合はさらに上記二電子酸化体により二電子酸化を受けると C=N 二重結合が形成され色素になります。
このインドアニリン色素形成反応はCoupling反応が律速であると解されます。
活性点置換型フェノール系又はナフトール系カプラー(以下、2等量カプラーと呼ぶ。)からのインドアニリン色素形成反応
脱離可能な原子または置換基が活性点の炭素に導入されたところの2等量カプラーのアニオン(HOMO)と
N,N-ジアルキルキノンジイミン(LUMO)とがCoupling反応してC-N結合が形成されると、
協奏的ニ分子反応であるαβ脱離反応が速やかに進行してC=N結合が形成され色素になります。
αβ脱離反応は塩基によるβ位窒素上の水素原子の引き抜きとα位活性点炭素上の脱離基の脱離反応とから成ります。
このインドアニリン色素形成反応中ではCoupling反応が律速反応と解されます。
(Coupling反応律速の範囲内で論じています。)
活性点炭素上の水素原子が置換されていると、
その活性点炭素の分子軌道係数(Cmrr)は減少するので、
Coupling反応の反応速度定数は活性点炭素未置換の場合に比べて小さくなってしまいます。
この様にCoupling反応が律速であると考え、第三項を用いて反応速度を説明し解釈することができるものとなります。
反応原材料となっているN,N-ジアルキルキノンジイミン(LUMO)を稀薄な状態で反応させる時に、
2等量カプラーのCoupling反応については、
意義を見出すことができるという一定の事情があります。
もっともメトキシ基等の脱離反応速度が遅い脱離基を活性点置換成分に導入すると、
脱離反応が律速になってしまいます。
(Coupling反応律速の範囲内ではなくなってしまいます。)
Coupling反応の反応速度は速くなっているはずなのにインドアニリン色素形成速度が遅い場合の説明になります。
以下、主としてCoupling反応が律速反応である場合について考えています。
上記2等量カプラーのCoupling反応の反応速度定数が、
4等量カプラーの場合に比べて小さくなっても、
当該Coupling反応のLUMO (N,N-ジアルキルキノンジイミン)が稀薄な状態という一定の事情の下で、
2等量カプラーからのインドアニリン色素形成速度は速くなる場合があります。
世界で初めてのインドアニリン色素形成反応速度論が回りはじめています。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(2)
フェノール系又はナフトール系カプラーのCoupling反応
Coupling反応速度定数=k
k=( kb・T/h ) { exp ( ΔrS°++/R ) } { exp ( -ΔrH°++/R T) }
ΔrH°++ ≈ E₀-RT
反応次数項は省略
E₀はカップリング反応の活性化エネルギーであり、
E₀の下降によりカップリング反応速度は速くなります。
⊿Etotal=-qr・qs / Rrs + 2(Cmrr・ Cnss・⊿β)² /(E*nr-E*ms)
(第二項クーロン項) (第三項電子移動相互作用項) (第一項は省略)
式中、
E*nr はカプラーアニオンHOMOのエネルギー順位、 E*msはキノンジイミンLUMOのエネルギー順位、
Cmrrはカプラー活性点炭素上のHOMOの分子軌道係数、
Cnssはキノンジイミン反応点窒素上のLUMOの分子軌道係数、
⊿βはC-N結合生成に伴い生ずる安定化エネルギーであり、
共鳴積分の変化量相当です。
homoとlumoとの電子移動相互作用の絶対値 | ⊿Etotal | が減少するることと反応速度とは直接関連するものではありませんが、
当該関連性を類推できる場合があります。
既述のhomo とlumoとのCoupling反応はその類推できる場合です。
そういう訳で、電子移動相互作用の絶対値が減少することによって、活性化エネルギー(E₀)は大きくなり、Coupling反応速度常数が減少し、Coupling反応速度が遅くなってしまいます。
絶対値を用いた表現をしているのは⊿Etotalは通常負の値だからです。
以下、電子移動相互作用 ⊿Etota の大きさについてはその絶対値をもって論じています。
弱酸と弱塩基の反応の結果共有結合(シグマボンド)が形成される反応は、電子移動相互作用支配で説明することが出来ます。
E*nr とE*msとの差を減ずることが有利です。
分母を小さくすると電子移動相互作用 ⊿Etotal を大きくすることが出来ます。
電子移動相互作用することで結合が生成してエネルギー的に安定になり、エネルギー順位の低い値が実現されます。
E*nr とE*msとの差は脱離速度が律速ではない範囲内で小さくすることが重要です。
0 notes
Text
世界初のインドアニリン色素形成反応速度論(1)
酸と塩基
Klopman(とSalem)の式中第二項がクーロン項で第三項が電子移動相互作用項です。
強酸と強塩基との反応は第二項によって説明し解釈され、弱酸と弱塩基との反応は第三項により説明したり、予想したりすることができます。
弱酸と弱塩基とのCoupling反応
弱酸と弱塩基の反応の結果共有結合(シグマボンド)が形成されるとき、その反応はCoupling反応の一種になります。
従ってCoupling反応は電子移動相互作用支配により説明されます。
静電的に(+)がLUMOとなり、静電的に(-)がHOMOとなっていますが分子軌道の符号は(+)と(+)または(-)と(-)とになります。
この反応は通常対称許容となっています。
LUMOとHOMOとのエネルギー順位が近いこ及びそれらの反応点原子の分子軌道係数が大きいことが電子移動相互作用を大きなものとします。
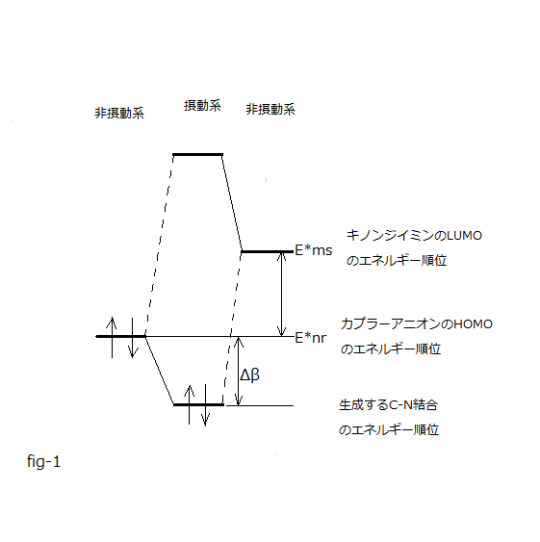
⊿Etotal=-qr・qs / Rrs +2(Cmrr・ Cnss・⊿β)² /(E*nr-E*ms)
(第二項クーロン項) (第三項電子移動相互作用項) (第一項は省略)
式中、
E*nrはカプラーアニオンHOMOのエネルギー順位、 E*msはキノンジイミンLUMOのエネルギー順位、
Cmrrはカプラー活性点炭素上のHOMO の分子軌道係数、
Cnssはキノンジイミン反応点窒素上のLUMO の分子軌道係数、
⊿βはC-N結合生成に伴い生ずる安定化エネルギーであり共鳴積分の変化量相当です。
0 notes